前言、
醫療環境的交叉感染,是醫護人員、病人及家屬長期關注及在意的問題,複雜病患聚集的半封閉醫療環境,交叉感染難以避免,如何能較大程度地降低交叉感染風險?
英國諾丁漢市立醫院微生物科(Department of Microbiology, Nottingham City Hospital),2005年進行了一項研究:評估使用HEPA濾網的移動式空氣清淨機(IQAir Cleanroom H13) 在臨床環境中,減少耐甲氧西林金黃色葡萄球菌(MRSA)污染的有效性。
研究結果表明:在研究物件病房中,使用IQAir Cleanroom H13空氣淨化器,MRSA環境污染率明顯降低75%-96%。
該研究及結果發表於2005年的《The Hospital Infection Society》
英國諾丁漢市立醫院微生物科(Department of Microbiology, Nottingham City Hospital),2005年進行了一項研究:評估使用HEPA濾網的移動式空氣清淨機(IQAir Cleanroom H13) 在臨床環境中,減少耐甲氧西林金黃色葡萄球菌(MRSA)污染的有效性。
研究結果表明:在研究物件病房中,使用IQAir Cleanroom H13空氣淨化器,MRSA環境污染率明顯降低75%-96%。
該研究及結果發表於2005年的《The Hospital Infection Society》
 耐甲氧西林金黃色葡萄球菌(MRSA)
耐甲氧西林金黃色葡萄球菌(MRSA)背景、MRSA菌血症疫情爆發
 諾丁漢市立醫院(圖片來源網路)
諾丁漢市立醫院(圖片來源網路)本文作者調查了一起爆發於血液科日間護理病房中的MRSA菌血症疫情,發現了MRSA對環境的嚴重污染。測定污染率的瓊脂沉降平皿在許多情況下MRSA呈陽性,這表明MRSA持續在向空氣中擴散。最終至少有2名患者被確診為MRSA重病患,當將他們隔離至單獨病房進行進一步的日間治療時,疫情得到控制。
這場疫情的爆發,促成了這次針對減少MRSA環境污染的技術研究。
健康保護局快速審核小組對一批空氣淨化產品進行了審查,其中包括空氣淨化裝置和紫外線空氣消毒裝置。其中兩種產品已被推薦用於臨床環境(推薦級別2)的在用評估,包括搭載HEPA濾網的IQAir Cleanroom H13移動式空氣清淨機。
這種移動式空氣清淨機通過反復將室內空氣經首層濾網,再通過高效顆粒物HEPA濾網,對過濾≥0.3微米的顆粒物淨化效率≥99.97%。
研究設計、
開啟/關閉及不同風速下,IQAir空氣清淨機對MRSA污染率的影響
本文介紹了在三種不同的臨床環境中,用瓊脂平皿沉降法測定三例MRSA重度傳播者隔離病房中水平面MRSA污染率。在不同的空氣淨化速率(60-235m³/h)下測量,並使用泊松回歸模型,將其與無空氣淨化下的數值作比較,以此評估IQAir空氣清淨機在減少MRSA環境表面污染方面的有效性。患者A:
61歲男性,患有急性髓性白血病,並伴有皮膚移植物抗宿主病,MRSA定植於2004年4月首次發現,儘管隨後進行了幾次三氯生洗滌和百多邦鼻膏治療,但仍在鼻、會陰和皮膚拭子中反復檢測到MRSA。患者B:
66歲男性,在進行複雜的上消化道手術後,於2005年3月首次檢測到MRSA定植,隨後儘管進行了兩個療程的三氯生/百多邦治療,仍從鼻、周圍神經、痰(氣管造口)、傷口拭子和腹腔引流處檢測到MRSA。患者C:
42歲男性,先前健康,在接受青黴素治療後出現嚴重的史蒂文斯-詹森綜合征,導致皮膚廣泛起泡,類似嚴重燒傷。入院6天后,在痰、血培養物和隨後的大量傷口拭子中檢測到MRSA。空氣淨化情況
患者A:
對於患者A,交替關閉、運行IQAir空氣清淨機,風速為235m³/h患者B:
對於患者B,先不進行空氣淨化,後運行IQAir空氣清淨機,風速分別為140m³/h、95m³/h和60m³/h患者C:
對於患者C,先不進行空氣淨化,後運行IQAir空氣清淨機,風速為235m³/h。測量及統計分析
在三個房間的指定位置放置了4至34個平皿,並暴露在空氣中1.5至8小時(見表一)。每個房間內盡可能使用相同平皿位置,分別置於地板周邊、床下、窗臺上、水槽邊、床頭櫃和其他可能的水平面上(見圖1)。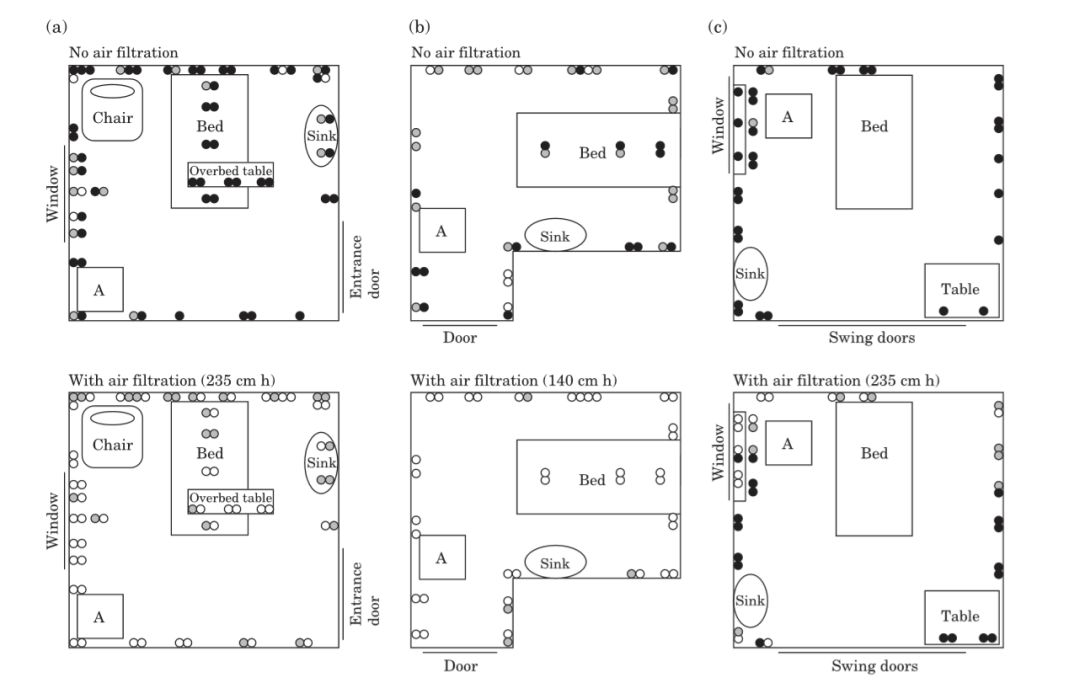
圖1:房間佈局及平皿佈局圖,A為空氣清淨機
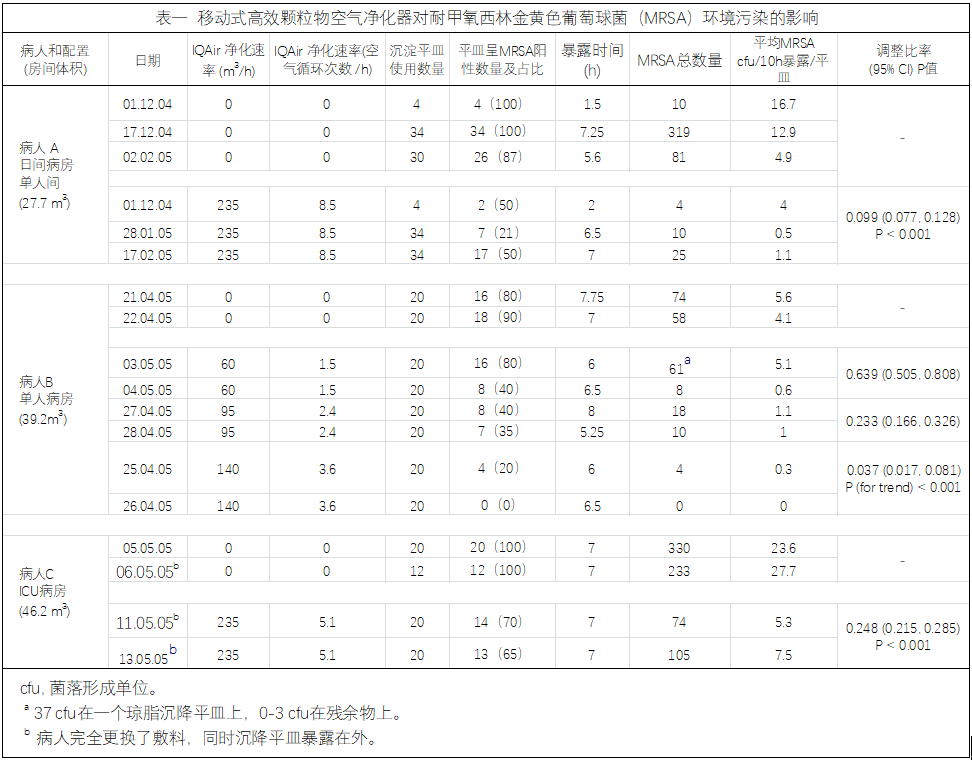
表一:研究資料統計
*研究期間,當空氣清淨機運行時,窗戶(門,盡可能)保持關閉。然而,在某些天為了病人的安全,門會保持開著,這減少了空氣迴圈次數,因而降低IQAir空氣清淨機的實際效果。如果在更嚴格控制的臨床環境中實驗,很可能實現更大程度地降低MRSA表面污染率。
另外,沒有記錄進入房間的人數,以及可能影響通風或MRSA擴散程度的所有其它因素(如鋪床),而這些因素可能造成每日資料的起伏。在研究時使用相對較長的平皿暴露時間,以便減弱這些潛在的變數。
實驗結果、使用HEPA空氣淨化器後,MRSA污染率最高降低96%
01.使用IQAir Cleanroom H13空氣清淨機前後,每位患者的MRSA環境污染率明顯降低75%-96%(見表一):
患者A病房
開啟空氣清淨機後(235m³/h風速),MRSA cfu/10h暴露/平皿的平均值數分別從16.7、12.9、4.9降為4.0、0.5、1.1。調整比率為0.099 (95% CI 0.077-0.128),降低約90%患者B病房
開啟空氣清淨機後(140m³/h風速),MRSA cfu/10h暴露/平皿的平均值數分別從5.6、4.1降至0.0、0.3。調整比率為0.037(95% CI 0.017-0.081),降低約96%患者C病房
開啟空氣清淨機後(235m³/h風速),MRSA cfu/10h暴露/平皿的平均值數分別從23.6、27.7降至5.3、7.5。調整比率為0.248(95% CI 0.215-0.285),降低約75%*CI:信賴區間
02.空氣淨化器不同風速下,MRSA環境水準表面污染率降低程度與空氣過濾速度有直接的關係:
患者B病房,當風速為60m³/h時,MRSA cfu/10h暴露/平皿的調整比率為0.639;當風速為95m³/h時為0.233;當風速為140m³/h時為0.037。
實驗意義、
對於減少醫患交叉感染及後續無效清潔,使用HEPA空氣淨化器是一種相對經濟高效的措施。越來越多的證據表明,環境可成為金黃色葡萄球菌的培養基,這可能會對患者造成交叉感染的風險2,3,7,13-16。在嚴重污染的環境裡,醫護人員的手、手套和衣服也有可能受到污染。研究發現65%的護士在照顧MRSA患者時,他們的制服或罩衣曾被MRSA污染,42%的人員沒有直接接觸這些患者,但接觸過房間內受污染的表面,他們的手套曾被MRSA污染過7。研究還表明,常規清潔和終端清潔並不能100%有效地清除環境中的MRSA3,4,因此,減少污染源空間的MRSA數量,可減少後續的無效清潔。
因此,在MRSA隔離室內放置IQAir HEPA空氣清淨機可以顯著減少MRSA對環境表面的污染。雖然這不能取代標準的感染控制措施(如隔離、手部衛生、防護服和清潔),但它有可能大大降低交叉感染風險,對MRSA的控制是一種相對經濟高效的方法。
[參考資料]
1. Boyce JM, Pittet D. Guideline for hand hygiene in health care settings: recommendations of the Healthcare Infection Control Practices Advisory Committee and the Hand Hy-giene Task Force. Infect Control Hosp Epidemiol 2003; 23(Suppl):1-40.
2. Talon D. The role of the hospital environment in the epide-miology of multi-drug resistant bacteria. J Hosp Infect 1999; 43:13-17.
3. Rampling A, Wiseman S, Davis L, et al. Evidence that hospi-tal hygiene is important in the control of MRSA. J Hosp Infect 2001;49:109-116.
4. French GL, Otter JA, Shannon KP, Adams NMT, Watling D, Parks MJ. Tackling contamination of the hospital environ-ment by MRSA: a comparison between conventional terminal cleaning and hydrogen peroxide vapour decontam-ination. J Hosp Infect 2004;57:31-37.
5. Ayliffe GAJ. Revised guidelines for the control of methicil-lin-resistant Staphylococcus aureus infection in hospitals. J Hosp Infect 1998;39:253-290.
6. Sheretz RJ, Reagan DR, Hampton KD, et al. A cloud adult: the Staphylococcus aureus-virus interaction revisited. Ann Intern Med 1996;124:539-547.
7. Boyce JM, Potter-Bynoe G, Chenevert C, King T. Environmental contamination due to methicillin-resistant Staphylococcus aureus: possible infection control impli-cations. Infect Control Hosp Epidemiol 1997;18:622-627.
8. Miller-Leiden S, Lobascio C, Nazaroff WW, Macher JM. Effectiveness of in-room air filtration and dilution ventila-tion for tuberculosis infection control. J Air Waste Manag Assoc 1996;46:869-882.
9. Lawrence JC, Lilly HA, Wilkins MD. Evaluation of a portable air purifier. J Hyg 1981;86:203-208.
10. Rutala WA, Jones SM, Worthington JM, Reist PC, Weber DJ. Efficacy of portable filtration units in reducing aerosolized particles in the size range of Mycobacterium tuberculosis. Infect Control Hosp Epidemiol 1995;16: 391-398.
11. Shiomori T, Miyamoto H, Makishima K, et al. Evaluation of bedmaking-related airborne and surface methicillin-resistant Staphylococcus aureus contamination. J Hosp Infect 2002;50:30-35.
12. Loo VG, Bertrand C, Dixon C, et al. Control of construction-associated nosocomial aspergillosis in an antiquated hematology unit. Infect Control Hosp Epidemiol 1996;17:
360-364.
13. Moore EP, Williams EW. A maternity hospital outbreak of methicillin-resistant Staphylococcus aureus. J Hosp Infect 1991;19:5-16.
14. Blythe D, Keenlyside D, Dawson SJ, Galloway A. Environ-mental contamination due to methicillin-resistant Staphy-lococcus aureus. J Hosp Infect 1998;38:67-70.
15. Kumari DN, Haji TC, Keer V, Hawkey PM, Duncanson V, Flower E. Ventilation grilles as a potential source of meth-icillin-resistant Staphylococcus aureus causing an outbreak in an orthopaedic ward at a district general hospital. J Hosp Infect 1998;39:127-133.
16. Layton MC, Perez M, Heald P, Patterson JE. An outbreak of mupirocin-resistant Staphylococcus aureus on a dermatol-ogy ward associated with an environmental reservoir. Infect Control Hosp Epidemiol 1993;14:369-375.
